INDICE
La tabla periódica de los elementos químicos es una herramienta fundamental en el estudio de la química. Esta tabla organiza los elementos de acuerdo a sus propiedades y nos proporciona información valiosa sobre sus características y comportamiento. Una de las propiedades más importantes de los elementos es su valencia, que determina la capacidad de un átomo para formar enlaces químicos con otros átomos.
En este artículo, exploraremos la tabla periódica valencias y cómo nos ayuda a comprender las propiedades de los elementos químicos. Descubriremos cómo se determina la valencia de un elemento y cómo esta información nos permite predecir la forma en que los átomos se unen para formar compuestos químicos. ¡Acompáñanos en este fascinante viaje a través de la tabla periódica valencias!

¿Qué es la valencia de un elemento?
La valencia de un elemento químico es la capacidad que tiene un átomo de ese elemento para unirse con otros átomos y formar compuestos químicos. La valencia se determina por la cantidad de electrones que un átomo necesita ganar, perder o compartir para alcanzar una configuración electrónica estable.
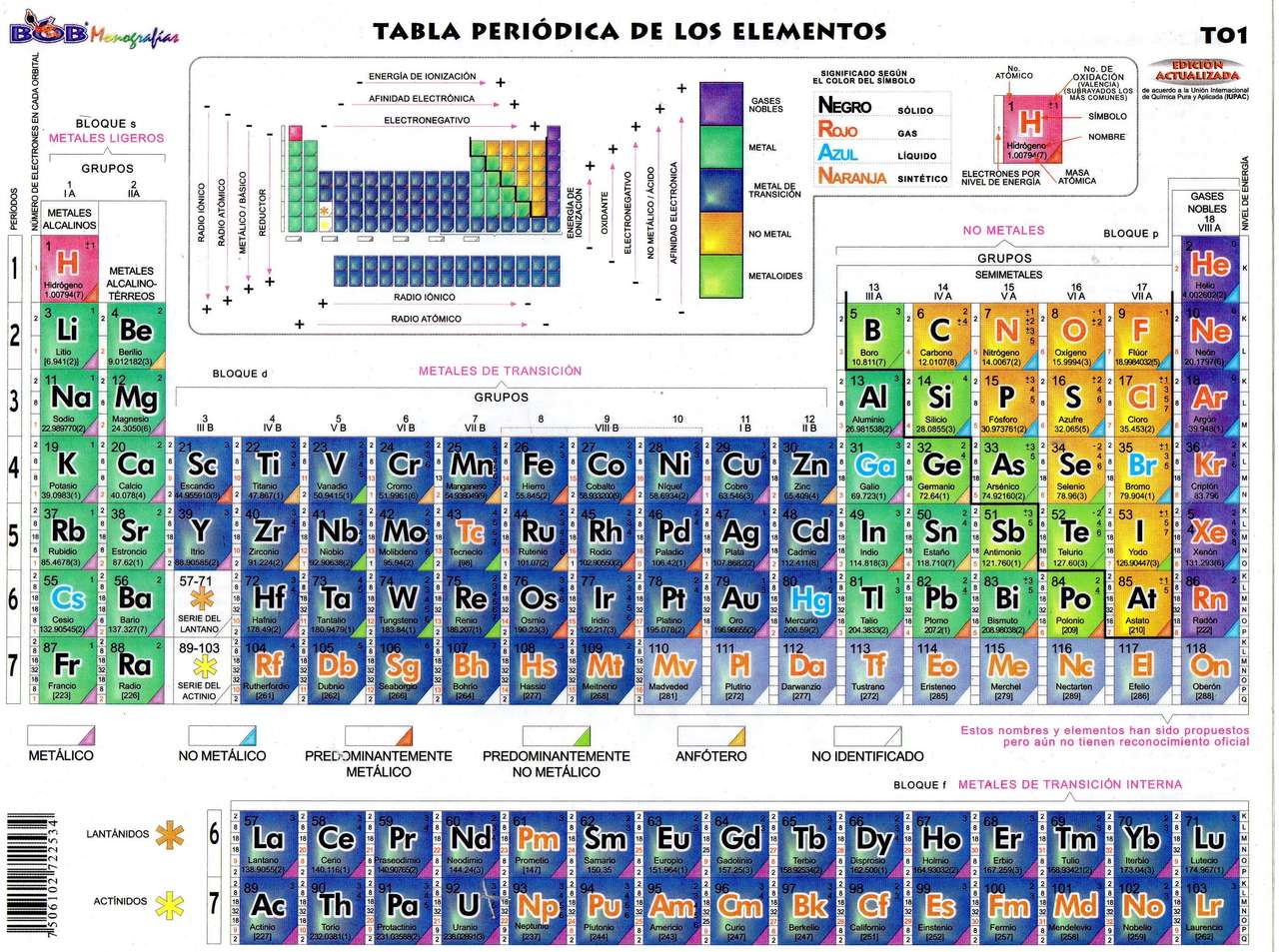
En la tabla periódica, la valencia de un elemento se indica mediante un número que se coloca en la parte superior derecha del símbolo del elemento. Este número representa la cantidad de electrones que un átomo de ese elemento puede ganar, perder o compartir durante una reacción química.
La valencia de un elemento puede ser positiva o negativa, dependiendo de si el átomo tiende a perder o ganar electrones durante una reacción química. Los elementos con valencia positiva tienden a perder electrones y formar iones positivos, mientras que los elementos con valencia negativa tienden a ganar electrones y formar iones negativos.

¿Cómo se determina la valencia de un elemento?
La valencia de un elemento se determina principalmente por su configuración electrónica, es decir, la distribución de
Introducción a la Tabla Periódica
La Tabla Periódica es una herramienta fundamental en el estudio de la química. Fue creada por el químico ruso Dmitri Mendeléyev en 1869 y desde entonces ha sido una guía invaluable para comprender las propiedades y comportamientos de los elementos químicos.
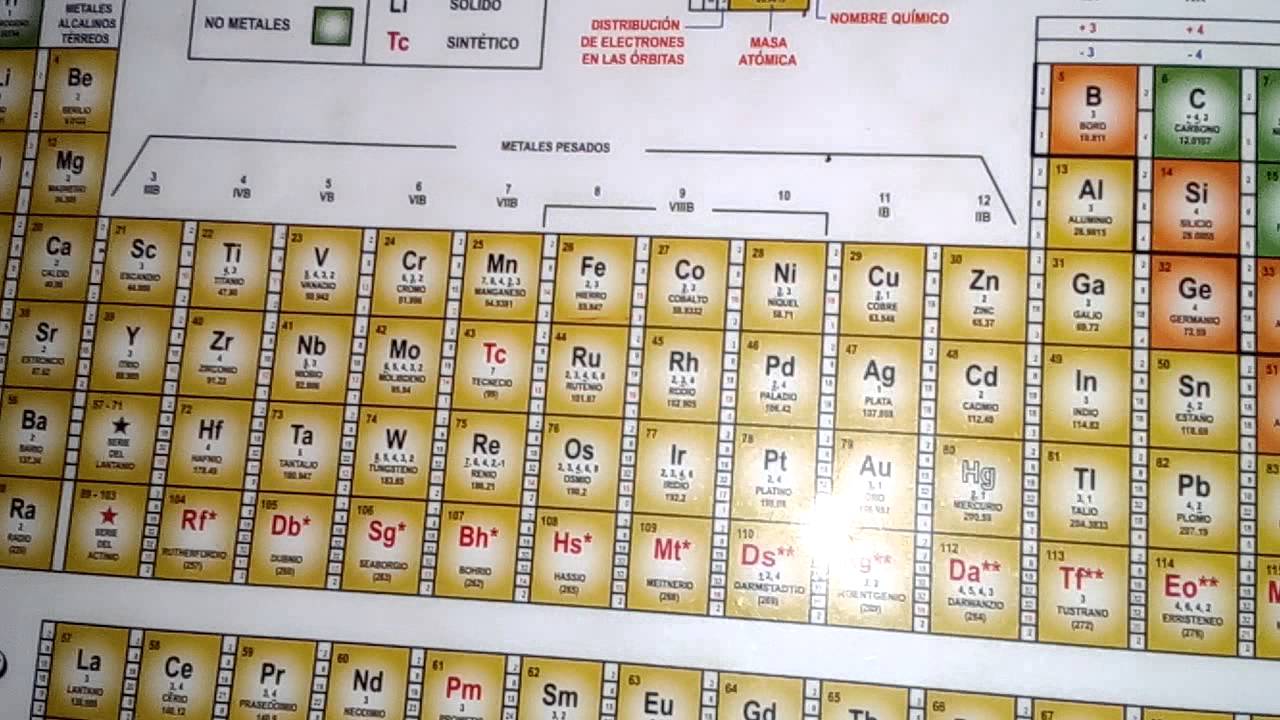
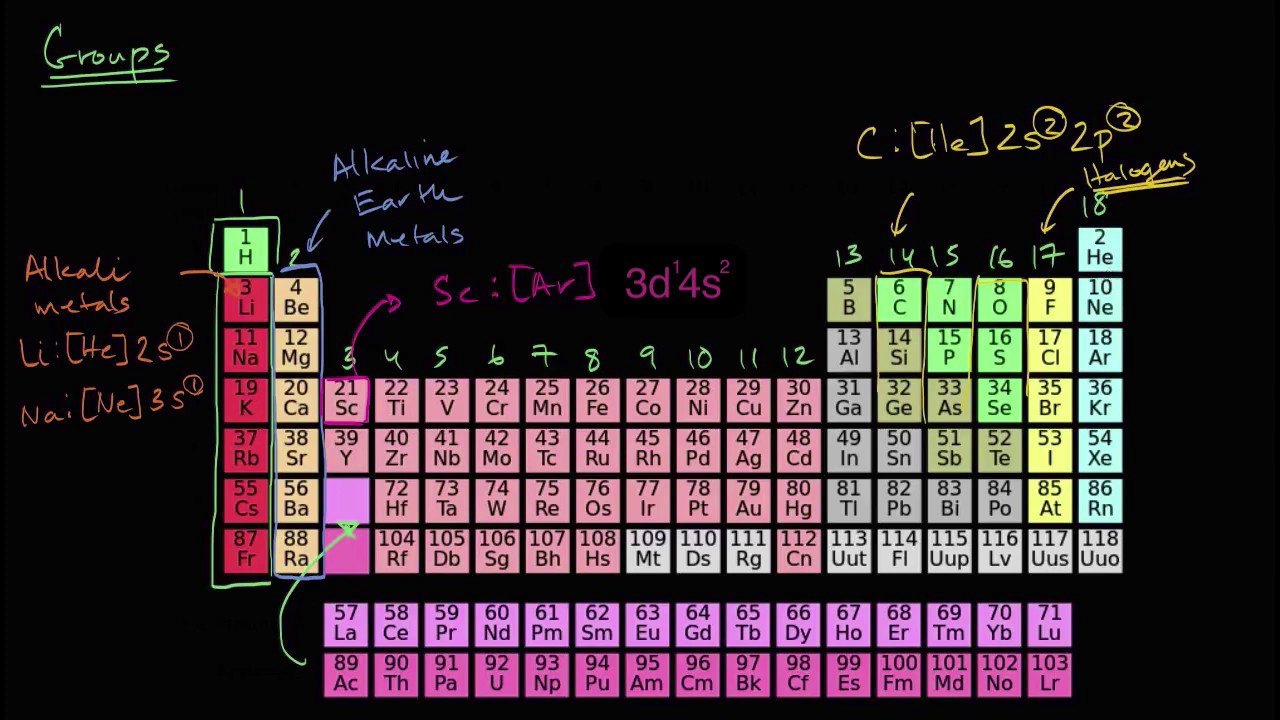
La Tabla Periódica organiza los elementos en filas horizontales llamadas periodos y en columnas verticales llamadas grupos. Cada elemento está representado por un símbolo químico y se encuentra ubicado en una posición específica de acuerdo a su número atómico y configuración electrónica.
Una de las características más importantes de la Tabla Periódica es que nos proporciona información sobre las valencias de los elementos. La valencia de un elemento químico indica la capacidad que tiene para formar enlaces químicos con otros elementos y determina las propiedades químicas y físicas de las sustancias que se forman.
Historia de la Tabla Periódica
La Tabla Periódica es una herramienta fundamental en el estudio de la química, ya que nos permite organizar y comprender las propiedades de los elementos químicos. Su historia se remonta al siglo XIX, cuando los científicos comenzaron a darse cuenta de que existían patrones y regularidades en las propiedades de los elementos.
Uno de los primeros intentos de organizar los elementos fue realizado por el químico alemán Johann Wolfgang Döbereiner en 1817. Él agrupó los elementos en tríadas, basándose en sus propiedades químicas similares. Sin embargo, esta clasificación resultó ser limitada y no incluía todos los elementos conocidos en ese momento.
Fue en 1869 cuando el químico ruso Dmitri Mendeléyev presentó su versión de la Tabla Periódica. Mendeléyev organizó los elementos en filas y columnas, de manera que los elementos con propiedades similares quedaran agrupados juntos. Además, dejó espacios vacíos para elementos que aún no habían sido descubiertos, pero que según sus predicciones deberían existir. Esta predicción se confirmó posteriormente con el descubrimiento de nuevos elementos.
¿Qué son las valencias en química?
Las valencias en química son una propiedad de los elementos químicos que determina su capacidad para formar enlaces químicos con otros elementos. La valencia de un elemento se refiere al número de electrones que puede ganar, perder o compartir para alcanzar una configuración electrónica estable. En otras palabras, la valencia nos indica cuántos enlaces puede formar un elemento y qué tipo de enlaces son posibles.
Las valencias se representan mediante números romanos o números positivos y negativos. Los elementos con valencias positivas tienden a perder electrones y formar cationes, mientras que los elementos con valencias negativas tienden a ganar electrones y formar aniones. Por ejemplo, el sodio (Na) tiene una valencia de +1, lo que significa que tiende a perder un electrón para formar un catión Na+. Por otro lado, el cloro (Cl) tiene una valencia de -1, lo que significa que tiende a ganar un electrón para formar un anión Cl-.
Importancia de conocer las valencias de los elementos
Conocer las valencias de los elementos químicos es fundamental para comprender cómo se combinan y reaccionan entre sí. Las valencias representan la capacidad de un átomo para ganar, perder o compartir electrones durante una reacción química. Estas valencias determinan la formación de enlaces químicos y la estabilidad de las moléculas resultantes.
Al comprender las valencias de los elementos, los químicos pueden predecir cómo se formarán los compuestos químicos y cómo se comportarán en diferentes condiciones. Esto es esencial para el desarrollo de nuevos materiales, medicamentos y tecnologías. Además, el conocimiento de las valencias permite identificar y solucionar problemas en procesos químicos, como la corrosión o la contaminación ambiental.
En resumen, conocer las valencias de los elementos químicos nos brinda una comprensión más profunda de la química y nos permite aprovechar su potencial para mejorar nuestras vidas y el mundo que nos rodea.

¿Cómo se determinan las valencias de los elementos?
Las valencias de los elementos químicos se determinan a través de su configuración electrónica. La configuración electrónica de un átomo indica cómo están distribuidos los electrones en los diferentes niveles de energía. Los electrones en el nivel más externo, conocido como capa de valencia, son los responsables de las propiedades químicas de un elemento.
Para determinar la valencia de un elemento, se debe analizar el número de electrones en la capa de valencia. Los elementos de la tabla periódica están organizados de manera que los elementos con propiedades similares se encuentran en la misma columna, llamada grupo. Los elementos de un mismo grupo tienen la misma cantidad de electrones en la capa de valencia, lo que les confiere propiedades químicas similares.
Por ejemplo, los elementos del grupo 1, como el hidrógeno y el litio, tienen un electrón en la capa de valencia, por lo que su valencia es +1. Los elementos del grupo 2, como el calcio y el magnesio, tienen dos electrones en la capa de valencia, por lo que su valencia es +2. Sin embargo, existen excepciones en la tabla periódica, como los elementos de transición, que pueden tener diferentes valencias dependiendo de las condiciones en las que se encuentren.
